Die Individualisierung in allen Lebenslagen macht auch vor dem Gesundheitswesen nicht Halt. Hier wird über Klonen und Stammzellen philosophiert, dort über das Aussuchen von Haar– und Augenfarbe der Kinder diskutiert. Doch neben Erinnerungen an Science Fiction Romane oder Zukunftsvisionen von Designer Babies sind die Assoziationen zu aktuellen gentechnischen Entwicklungen meist äußerst limitiert. Mit welchem Werkzeug die Ärzte von morgen tatsächlich arbeiten werden, beantworten wir mit einer Reise zum mikroskopischen Ursprung des Lebens.
Der molekulare Bauplan
Gemeint ist die DNA. Diese lässt sich metaphorisch wie ein Buch mit Millionen an Seiten beschreiben. Bestimmte Kapitel – die sogenannten Gene – enthalten sämtliche Informationen darüber, wie ein jedes Lebewesen aufgebaut ist. Zuvor müssen sie aber in eine “andere Sprache” – die RNA – umgeschrieben werden.
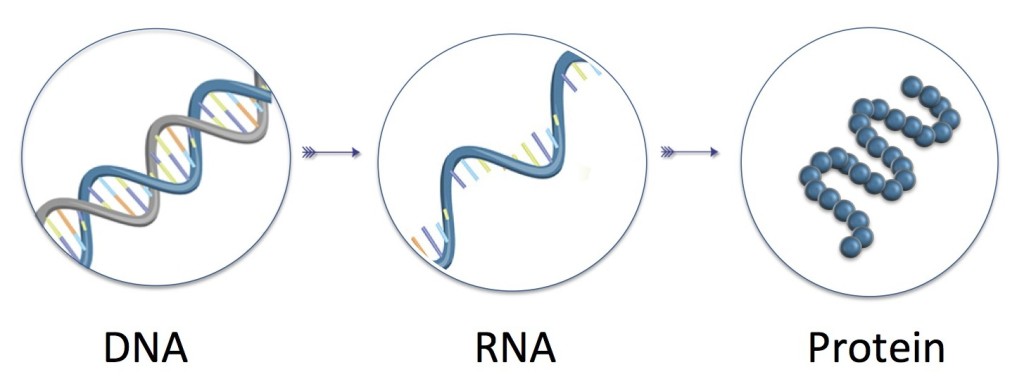
Aus dem übersetzten Bauplan können nun Proteine hergestellt werden, die Form und Funktionalität eines Organismus bestimmen und regulieren. Teilt sich eine Zelle – zum Beispiel beim Wachsen der Haare – muss wiederum die gesamte DNA kopiert werden. Doch weder dieser Schreib–, noch der Leseprozess verlaufen reibungslos – im Leben eines jeden Menschen treten unzählige Fehler – sogenannte Mutationen – auf.
Mit diesen Veränderungen beschäftigen sich unter anderem auch die drei diesjährigen Chemie–Nobelpreisträger Thomas Modrich, Paul Lindahr und Aziz Sancar, die sich der Untersuchung von potentiellen Reparaturmechanismen für beschädigte DNA–Abschnitte verschrieben haben.

Lost in Translation
Meistens sind Mutationen stumm, das heißt die Veränderung der DNA hat keinen Einfluss auf das daraus entstehende Protein, geschweige denn die Gesundheit des Menschen. Bestimmte Veränderungen können jedoch Krankheiten auslösen – oder beeinflussen, ob und wie ein Medikament bei einem Patienten wirkt.
Univ.–Doz. Dr. Krugluger (SMZ Ost) sprach beim Colloquium der Gesundheit Österreich zum Thema der maßgeschneiderten Medizin. Seiner Meinung nach werden Begrifflichkeiten “je nachdem, mit wem man redet, unterschiedlich verstanden.” Der aktuelle Fortschritt – sowie der daraus entstandene Hype – beschäftige sich aber in erster Linie mit dem Treffen “medizinischer Entscheidungen auf Grundlage des genetischen Profils.”
Entsprechende Methoden und Technologien, die individuelle Veränderungen in der DNA untersuchen, haben in den letzten Jahren eine enorme Entwicklung durchgemacht. Daraus entstanden bisher Therapiemöglichkeiten, mit denen Nebenwirkungen von Medikamenten minimiert und ein höheres Maß an Wirksamkeit erzielt werden können.
Ursachen auf der Spur
Im Kontext der Krebsmedizin bedeutet das, „die Therapie auf die für den Tumor typischen molekularen Veränderungen auszurichten,“ erklärt Dr. Leonhard Müllauer vom Forschungsprojekt MONDTI am Wiener AKH – denn selbst zwei „gleich ausschauende“ Tumore von zwei verschiedenen Patienten unterscheiden sich in Art und Zahl genetischer Veränderungen –und in daher auch in potentiellen Behandlungsmöglichkeiten.
Werden sie entsprechend identifiziert, können sogenannte „targeted therapies“ eingesetzt werden. Dafür werden Medikamente verwendet, deren Wirkung auf eine spezifische genetische Veränderung zugeschnitten sind. Hilfreich, dass inzwischen eine ganze Reihe an Mutationen bekannt sind, die mit verschiedenen Varianten von bestimmten Krankheiten assoziiert sind.
Präventiv – also ohne bestehenden Verdacht auf Erkrankung – werden personalisierte Ansätze bisher nur bei familiären Tumorsyndromen eingesetzt: „Zum Beispiel die Bestimmung des BRCA1/2 Genstatus bei Brust–und Eierstockkrebs“ – wie zuletzt wieder in den Medien berichtet wurde.

Bewusstsein der Gesellschaft
Wäre das Wissen über die aktuellen Möglichkeiten und zukünftige Entwicklungen bereits vollständig in der Öffentlichkeit angekommen, „müsste der Ruf nach einem Ausbau der molekularen Diagnostik in den Krankenhäusern entstehen“, meint Dr. Müllauer, aber „die Betroffenen scheinen wenig informiert.“
Einen weiteren Grund für Zurückhaltung sieht Dr. Krugluger in der ökonomischen Perspektive auf das Gesundheitssystem. Je individueller die Behandlungen, desto größer der Aufwand: „Es wird in Zukunft nicht einfach werden, tatsächlich alles im Auge zu behalten und – ohne technische Hilfsmittel, die Abhilfe schaffen – klinische Abläufe nicht zu überfordern.“
„Tatsächlich für einen einzelnen Patienten eine Therapie zu entwickeln ist momentan industriell nur schwer machbar.“ Mit dieser Herausforderung der klinischen Umsetzung von wissenschaftlichen Erkenntnissen gehen natürlich auch Gefahren einher, dass aufgrund wirtschaftlicher Interessen medizinische Entscheidungen getroffen werden.

Herausforderung der Wissenschaften
Allerdings könne dem vor allem „gute objektive Wirksamkeitsstudien, kritisches Denken und eigenständige akademische Forschung entgegenwirken“, resümiert Dr. Müllauer. Was bislang in erster Linie nur für Krebspatienten vorgesehen war, könnte mit den entsprechenden Schritten also bald in anderen Disziplinen zum medizinischen Standard gehören.
Dafür benötigt es aber ein komplexes Konstrukt an wissenschaftlichen Perspektiven, um zuverlässig Therapien für bestimmte Patienten auf Grundlage des genetischen Profils zu erarbeiten. „Ich denke, es braucht noch sehr viel Zeit“, meint Dr. Krugluger zum Abschluss, „und die sollten wir uns auch nehmen.“
Während die Medizin noch mit der Komplexität der individuellen Vielfalt zu kämpfen hat, ist Personalisierung in anderen Bereichen bereits in der Gegenwart angekommen. Mehr darüber berichten wir bald in Teil 3 unseres Schwerpuntks zum Thema Customizing.
Text: Philipp Greiner